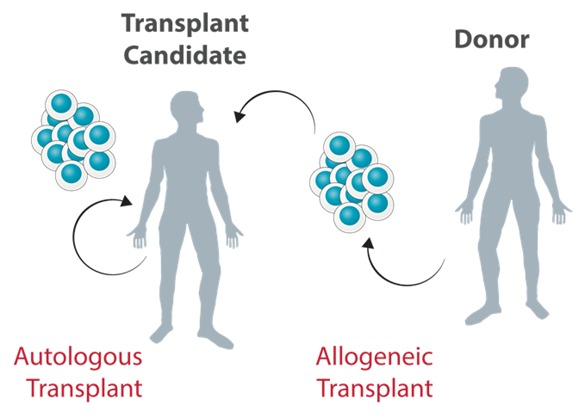
Mesenchymal Stem Cell (MSC) merupakan stem cell laboratory yang paling umum digunakan dalam terapi sel. Maka dari itu, terapi MSC membuka harapan baru karena telah menunjukkan hasil yang menjanjikan dalam pengobatan berbagai penyakit seperti penyakit kardiomiopati, penyakit jantung iskemik, dan osteoarthritis (Rodríguez-Fuentes et al., 2021). Selain itu, terdapat lebih dari 1000 uji klinis MSC yang telah teraftar di clinicaltrials.gov, dimana di tahun 2019, uji klinis MSC memiliki cakupan penyakit yang luas dimulai dari penyakit musculoskeletal, metabolik, autoimun, hingga acute graft versus host disease (GvHD) . Dalam aplikasi klinisnya, terapi MSC dibagi menjadi dua yaitu Autologous and Allogeneic. Terapi MSC Autologous memanfaatkan MSC yang diisolasi dari pasien itu sendiri, sedangkan terapi allogeneic menggunakan MSC yang berasal dari donor. Terapi autologous memiliki kekurangan yaitu proses yang kompleks dan memakan waktu lama serta kualitas sel yang kurang baik karena berasal dari sumber yang tidak sehat, tantangan-tantangan dalam terapi Autologous ini dapat teratasi oleh terapi Allogeneic yang memiliki prosedur relatif lebih cepat (Kot et al., 2019). Namun dalam terapi Allogeneic, pemilihan donor merupakan aspek yang sangat krusial demi mendapatkan sumber MSC yang berkualitas.
Salah satu usaha untuk menjaga kualitas sumber MSC yaitu dari penentuan donor yang berkualitas. Donor yang dijadikan sumber MSC sebaiknya tidak berasal dari hewan karena dapat meningkatkan resiko penolakkan dan penularan penyakit infeksius (Boneva et al., 2001). Dalam mendapatkan donor manusia yang berkualitas, dapat dilakukan skrining terlebih dahulu yang bertujuan untuk memastikan bahwa calon donor tidak memiliki penyakit-penyakit infeksi serta resiko kanker yang dapat meningkatkan resiko penularan terhadap resipien MSC di masa mendatang.
Pemilihan atau skrining g serta pemrosesan sumber MSC dari donor harus mematuhi regulasi yang berlaku, sebagai contoh US Food and Drug Administration (FDA) menetapkan bahwa donor harus menjalani skrining untuk HIV-1, HIV-2, Hepatitis B Virus (HBV), Hepatitis C Virus (HCV), dan Treponema pallidum (“CFR – Code of Federal Regulations Title 21”, 2020). Selain penyakit infeksius, regulasi dari United Kingdom (UK) Advisory Committee on the Safety of Blood, Tissues, menetapkan untuk pemeriksaan terkait genetik untuk mencegah resiko terjadinya kanker, selain itu pemeriksaan riwayat Kesehatan keluarga juga direkomendasikan. Selain pemeriksaan kesehatan, ketelusuran donor juga harus diperhatikan (“Donation of Starting Material for Cell-Based Advanced Therapies: a SaBTO Review”, 2014). Yang terakhir, hal yang tidak kalah penting dalam pemilihan donor yang baik adalah persetujuan donor itu sendiri melalui Informed Consent (Vaz et al., 2018).
Reference:
Boneva, R., Folks, T., & Chapman, L. (2001). Infectious Disease Issues in Xenotransplantation. Clinical Microbiology Reviews, 14(1), 1-14. https://doi.org/10.1128/cmr.14.1.1-14.2001
CFR – Code of Federal Regulations Title 21. Accessdata.fda.gov. (2020). Retrieved 22 June 2021, from https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=1271.
Donation of Starting Material for Cell-Based Advanced Therapies: a SaBTO Review. Assets.publishing.service.gov.uk. (2014). Retrieved 22 June 2021, from https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/326823/Cellular_Therapy.pdf.
Kot, M., Baj-Krzyworzeka, M., Szatanek, R., Musiał-Wysocka, A., Suda-Szczurek, M., & Majka, M. (2019). The Importance of HLA Assessment in “Off-the-Shelf” Allogeneic Mesenchymal Stem Cells Based-Therapies. International Journal Of Molecular Sciences, 20(22), 5680. https://doi.org/10.3390/ijms20225680
Rodríguez-Fuentes, D., Fernández-Garza, L., Samia-Meza, J., Barrera-Barrera, S., Caplan, A., & Barrera-Saldaña, H. (2021). Mesenchymal Stem Cells Current Clinical Applications: A Systematic Review. Archives Of Medical Research, 52(1), 93-101. https://doi.org/10.1016/j.arcmed.2020.08.006
Vaz, W., Shirazian, A., Smith, S., Chen, Q., Fong, T., & Lee, J. et al. (2018). Sourcing Clinical-Grade Human Tissue: Considerations for Supporting Cell Therapy Development and Production – BioProcess International. BioProcess International. Retrieved 22 June 2021, from https://bioprocessintl.com/manufacturing/cell-therapies/sourcing-clinical-grade-human-tissue-considerations-for-supporting-cell-therapy-development-and-production/.