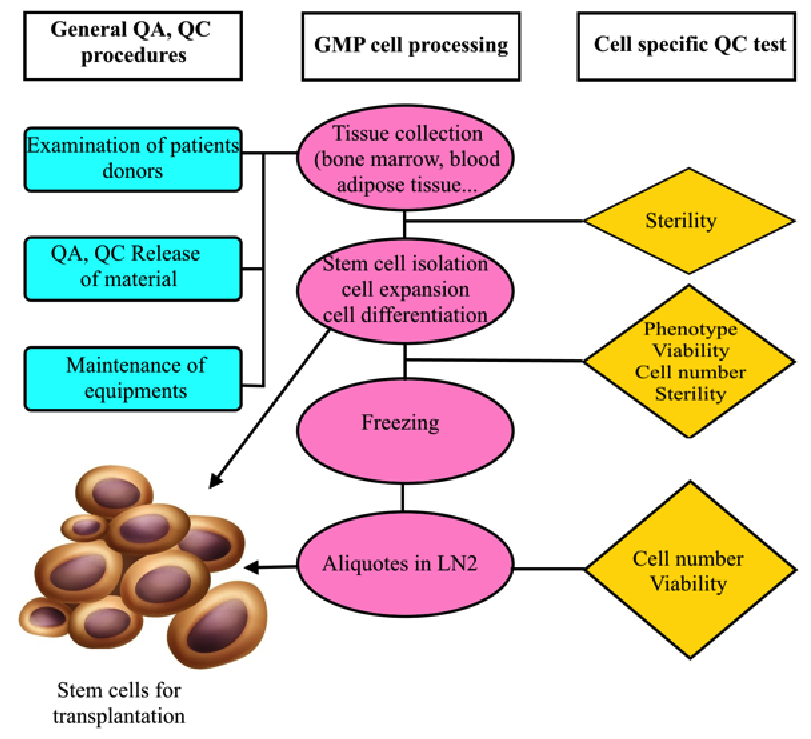
Alur produksi Mesechymal Stem Cells (MSC) for clinical purpose (Pham & Vu, 2016)
Mesenchymal Stem Cells (MSC) merupakan salah satu cell therapy yang menjanjikan untuk banyak penyakit dan cedera serius, termasuk penyakit metabolik, degeneratif, dan inflamasi, perbaikan dan regenerasi jaringan yang rusak. Hal ini dapat terjadi karena sifat multipotency yang dapat berdiferensiasi menjadi sel dan jaringan mesodermal. Selain itu MSC juga mengeluarkan berbagai faktor yang dapat memberikan efek imunomodulator, pembentukan jaringan, migrasi, dan properti homing (Galvez-Martin et al., 2016 ; Lavrentieva, Hoffmann & Lee-Thedieck, 2020). Untuk memastikan kualitas MSC, bioprosesing MSC melibatkan aspek yang kompleks mulai dari persyaratan fasilitas, pemilihan donor, prosedur isolasi dan perbanyakan MSC, penggunaan bahan baku hingga pengawasan kualitas. FASILITAS Setiap prosedur yang terkait dengan penerapan klinis MSC memerlukan kontrol yang untuk memastikan bahwa produk tersebut aman, konsisten, efektif dan berkualitas baik. Pemantauan lingkungan harus mencakup serangkaian pengendalian fisik seperti konsentrasi partikel di udara, aliran udara, High-efficiency particulate air (HEPA), differential pressure, suhu, relative humidity, dan uji mikrobiologi. Pemantauan rutin terhadap lingkungan, proses, dan produk MSC harus dilakukan sesuai dengan prosedur dan sejalan dengan standar serta pedoman yang dirancang untuk memantau partikulat dan mikroorganisme secara rutin di area kritis dan memberikan informasi yang berarti tentang kualitas yang aseptik (Galvez-Martin et al., 2016). PEMILIHAN DONORLangkah pertama produksi MSC adalah isolasi dari donor. Kelayakan donor harus dievaluasi berdasarkan riwayat kesehatan, pemeriksaan fisik, tes darah, dan skrining penyakit menular. Evaluasi ini dilakukan untuk memastikan bahwa MSC yang diisolasi memiliki kualitas yang baik serta memastikan produk akhir bebas dari patogen (Kolkundkar, 2014).
PRODUKSI Prosedur standar kultur MSC, termasuk untuk tujuan aplikasi klinis, adalah melalui kultur monolayer. Oleh karena itu mempertimbangkan kualitas culture flask sangat penting (Pham & Vu, 2016). Dalam produksinya, MSC ditumbukan di media yang memberikan sumber protein untuk mendukung pertumbuhan MSC. Protein dapat ditambahkan dari suplemen seperti fetal bovine serum (FBS) atau human platelet lysate (HPL). Namun penggunaan FBS dapat menimbulkan reaksi imunologi pada pasien dan senyawa xenogenik hewan seperti protein dan polisakarida dapat menyebabkan respon imun setelah implantasi MSCs. Selain itu senyawa xenogenik, juga menyebabkan infeksi virus, mycoplasma, atau prion berpindah ke pasien. Oleh karena itu untuk mencapai keamanan, suplementasi dapat menggunakan HPL. (Hanley et al, 2013; Lavrentieva, Hoffmann & Lee-Thedieck, 2020). Langkah-langkah harvest yang perlu diperhatikan karena akan mempengaruhi viabilitas, diferensiasi, dan jumlah sel diantara lain durasi harvest yang harus diselesaikan dalam waktu 2 jam, verifikasi proses dan bahan. Teknik detachment juga penting, detachment dapat dilakukan dengan enzim atau menggunakan cell scraper. Penggunaan metode berbasis cell scraper memengaruhi jumlah sel hidup yang dilepaskan. Salah satu enzim yang biasa digunakan untuk detachment adalah Trypsin / EDTA. Namun enzim tersebut tidak GMP-complaince karena berasal dari porcine. Sebagai alternatif, penggunaan enzim untuk detachment dapat menggunakan enzim yang GMP-complaince (Kolkundkar, 2014; Pham & Vu, 2016). PENGUJIAN QUALITY CONTROL (QC) Sistem QC yang mapan diperlukan untuk memastikan bahwa kualitas produk serta bahan mentah yang digunakan selama pemrosesan karena keamanan dan kemurnian produk pada akhirnya akan bergantung pada bahan bakunya (Kolkundkar, 2014). Tes yang biasanya diterapkan untuk QC adalah sterilitas, mikoplasma, endotoksin, dan viability. Selain itu, evaluasi identitas MSC dapat dilakukan melalui ekspresi cell surface marker. Selain itu, uji diferensiasi juga penting karena MSCs harus mampu berdiferensiasi menjadi osteoblast, adipocyte, and chondroblast. Karyotyping juga diperlukan untuk mengevaluasi kelainan kromosom dalam sel (Hanley et al., 2013 & Pham & Vu, 2016).
References
Galvez-Martin, P., Sabata, R., Verges, J., Zugaza, J., Ruiz, A., & Clares, B. (2016). Mesenchymal Stem Cells as Therapeutics Agents: Quality and Environmental Regulatory Aspects. Stem Cells International, 2016, 1-14. doi: 10.1155/2016/9783408
Hanley, P., Mei, Z., da Graca Cabreira-Hansen, M., Klis, M., Li, W., & Zhao, Y. et al. (2013). Manufacturing mesenchymal stromal cells for phase I clinical trials. Cytotherapy, 15(4), 416-422. doi: 10.1016/j.jcyt.2012.09.007
Kolkundkar, U. (2014). Cell Therapy Manufacturing and Quality Control: Current Process and Regulatory Challenges. Journal Of Stem Cell Research & Therapy, 04(09). doi: 10.4172/2157-7633.1000230
Lavrentieva, A., Hoffmann, A., & Lee-Thedieck, C. (2020). Limited Potential or Unfavorable Manipulations? Strategies Toward Efficient Mesenchymal Stem/Stromal Cell Applications. Frontiers In Cell And Developmental Biology, 8. doi: 10.3389/fcell.2020.00316
Pham, P., & Vu, N. (2016). In vitro expansion of mesenchymal stem cells for clinical use. Progress In Stem Cell, 3(02), 87. doi: 10.15419/psc.v3i02.123