Mesenchymal Stem Cell (MSC) telah lama dikenal sebagai kandidat terapi berbasis sel yang menjanjikan. Karakteristik utama yang dimiliki oleh MSC adalah kemampuannya dalam meregenerasi dirinya sendiri (self-renewal), memperbanyak diri dengan cepat, serta berdiferensiasi menjadi berbagai jenis sel lain. MSC dapat diisolasi dari beberapa jaringan dewasa, seperti sumsum tulang, jaringan adiposa, pulpa gigi, tali pusat1, darah tali pusat, dan juga darah tepi2. Tali pusat merupakan salah satu sumber MSC yang paling banyak digunakan dalam uji klinis maupun aplikasi klinis1. MSC yang diisolasi dari jaringan tali pusat bayi dikenal juga sebagai Umbilical Cord-Mesenchymal Stem Cell (UC-MSC). Proses pengambilan tali pusat ini relatif mudah serta dilakukan secara non-invasif1, sehingga tidak menimbulkan efek samping dan rasa sakit bagi ibu maupun bayinya. Pada proses isolasi UC-MSC, jaringan yang diambil dari tali pusat bayi adalah Wharton’s Jelly. Wharton’s Jelly merupakan komponen terbesar penyusun tali pusat berupa jaringan ikat mukoid dengan kandungan MSC yang berlimpah3.
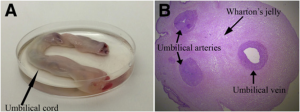
Gambar 1. Umbilical cord (a) and Wharton’s jelly (b).
(Liau et al., 2019)
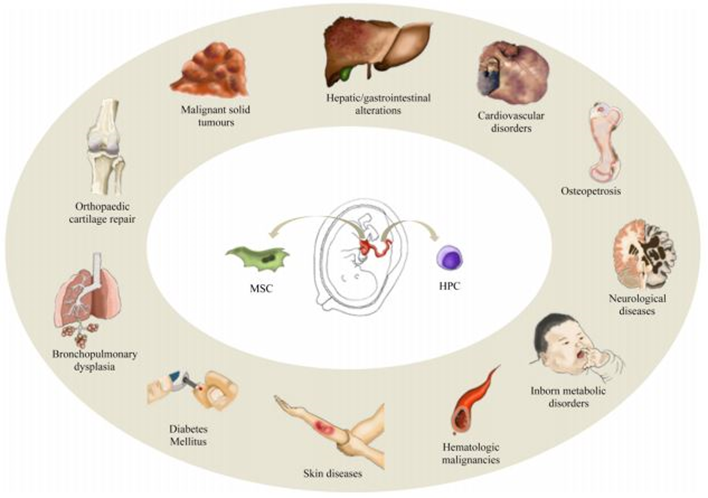
UC-MSC memiliki potensi besar untuk berkembang menjadi berbagai jenis sel lain di dalam tubuh, meliputi osteosit (tulang keras), kondrosit (tulang rawan), adiposit (lemak), dan juga neuron (saraf)5. Beberapa keunggulan yang dimiliki oleh UC-MSC diantaranya adalah kemampuan memperbanyak diri yang paling baik apabila dibandingkan dengan sumber MSC lainnya, mampu mensekresikan faktor-faktor parakrin, serta memiliki tingkat risiko yang rendah terhadap penyebaran infeksi dan reaksi penolakan imun oleh tubuh4,5. Selain itu, UC-MSC juga terbukti dapat menghasilkan berbagai senyawa bioaktif seperti interleukin-10, interleukin-6, faktor pertumbuhan endotel vaskular, faktor pertumbuhan hepatosit, dan faktor penghambat leukimia5.
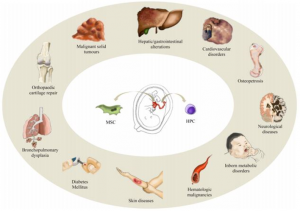
Gambar 2. Aplikasi klinis UC-MSC dan HSC
(Roura et al., 2015)
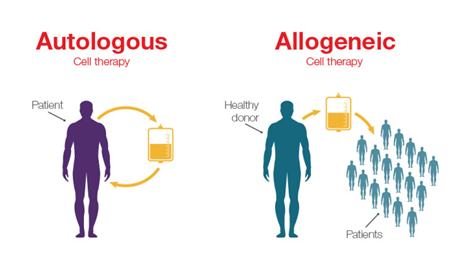
Penggunaan UC-MSC dalam terapi regeneratif baik melalui transplantasi autologus maupun alogenik telah banyak dilakukan, terutama karena berbagai keunggulan dan potensi yang dimilikinya. Perbedaan kedua jenis transplantasi UC-MSC tersebut terletak pada sumber donornya, dimana autologus merupakan transplantasi yang sumber sel puncanya berasal dari pasien itu sendiri sedangkan sumber sel punca alogenik berasal dari donor atau orang lain yang tidak memiliki hubungan kekerabatan dengan pasien. Sifat regeneratif dan imunosupresif yang dimiliki oleh UC-MSC menyebabkan tingginya penggunaan UC-MSC dalam berbagai penelitian maupun aplikasi klinis. UC-MSC autologus dapat digunakan dalam terapi regeneratif untuk penyakit bawaan lahir seperti cerebral palsy dan hypoxic brain damage6. Sementara itu, aplikasi UC-MSC secara alogenik banyak digunakan dalam terapi pengobatan berbagai penyakit seperti osteoarthritis7, wound healing8, alopecia9, Chronic Obstructive Pulmonary Disease (COPD)10, Acute Myocardial Infarction11 (AMI), dan lain sebagainya.
Berbeda halnya dengan jaringan tali pusat yang kaya akan MSC, darah tali pusat atau Umbilical Cord Blood merupakan sumber Hematopoietic Stem Cell (HSC) yang potensial untuk digunakan sebagai terapi pada pasien dengan kelainan hematologi, seperti leukimia, limfoma, myeloma, fanconi anemia, sindrom mielodisplasia12,13, dan sickle cell disease2. Umumnya, sel punca ini hanya digunakan untuk terapi autologus. Sel punca yang terdapat dalam darah tali pusat akan disimpan terlebih dahulu dalam bentuk Mononuclear Cells (MNC) serta perlu dilakukan proses kultur lebih lanjut jika ingin menghasilkan MSC14, sementara jaringan tali pusat yang diisolasi dapat langsung dikultur dan diperbanyak secara in vitro untuk menghasilkan MSC dalam jumlah yang besar15. Volume darah tali pusat yang dikoleksi relatif rendah atau sedikit dibandingkan dengan sumber sel punca lainnya seperti darah tepi dan sumsum tulang, sehingga berpengaruh terhadap jumlah sel punca yang dihasilkan12. Kemampuan diferensiasi yang luas dan self-renewal yang tinggi dari UC-MSC menjadi salah satu perbedaan yang menguntungkan dibandingkan dengan sel punca yang dihasilkan dari sumber lain seperti Umbilical Cord Blood, sehingga aplikasi klinis menggunakan UC-MSC dapat diterapkan secara luas baik secara autologus maupun alogenik.
DAFTAR PUSTAKA
- Skiles, M.L., Allen, J.M., Katherine, S.B., Jaime, M.S. 2020. Comparison of Umbilical Cord Tissue-derived Mesenchymal Stromal Cells Isolated from Cryopreserved Material and Extracted by Explantation and Digestion Methods Utilizing a Split Manufacturing Model. Vol. 22:581-591.
- McGill, E., and Vincent, S.G. 2020. Stem Cells in The Treatment of Sickle Cell Disease. Stem Cell Res. Ther. Vol. 6(1):32-39.
- Talebian, N., Kazem, P., Laya, K., Mohsen, M., Maryam, S., and Mohammad, T.J. 2013. Comparative Analysis of Mesenchymal Stem Cells Isolated from Human Bone Marrow and Wharton’s Jelly. Anatomical Sciences Journal. 10(2):73-78.
- Balgi-Agarwal, S., Caitlyn, W., Alexis, C., Shamimunisa, B.M., Peter, H., and Alvaro, M. 2018. Comparison of Preterm and Term Wharton’s Jelly-Derived Mesenchymal Stem Cell Properties in Different Oxygen Tensions. Cells Tissues Organs. 205:137-150.
- Nasadyuk, C.M. 2016. Umbilical Cord Stem Cells: Biological Characteristics, Approaches to Banking and Clinical Application. Cell and Organ Transplantology. 4(2):230-235.
- Nagamura-Inoue, T., and He, H. 2014. Umbilical Cord-derived Mesenchymal Stem Cells: Their Advantages and Potential Clinical Utility. World Journal of Stem Cells. Vol. 6(2):195–202.
- Wang, A., Ying, F., Hong-Hong, J., Meng, Z., and Hao, Y. 2019. Application of Mesenchymal Stem Cell Therapy for the Treatment of Osteoarthritis of the Knee: A Concise Review. World Journal of Stem Cells. Vol. 11(4):212-235.
- Jeschke, M.G., Sarah, R., Matthew, R.M., and Shahriar, S. 2019. Allogeneic Mesenchymal Stem Cells for Treatment of Severe Burn Injury. Stem Cell Research & Therapy. 10(337):1-6.
- Gentile, P., and Simone, G. 2019. Advances in Regenerative Stem Cell Therapy in Androgenic Alopecia and Hair Loss: Wnt Pathway Growth-Factor, and Mesenchymal Stem Cell Signaling Impact Analysis on Cell Growth and Hair Follicle Development. Vol. 8(466):1-21.
- Bich, P.L.T., Ha, N.T., Hoang, D.N.C., et al. 2020. Allogeneic Umbilical Cord-Derived Mesenchymal Stem Cell Transplantation for Treating Chronic Obstructive Pulmonary Disease: A Pilot Clinical Study. Stem Cell Research and Therapy. 11(60):1-14.
- Carbone, R.G., Monselise, A., Bottino, G., Negrini, S., and Puppo, F. 2021. Stem Cells Therapy in Acute Myocardial Infarction: A New Era. Clinical and Experimental Medicine. 21:231-237.
- Sivakumaran, N., Imesha, R.R., Rashida, S., Sasini, S.W., Sumalimina, J., and Mahisha, C. 2018. Umbilical Cord Blood Banking and Its Therapeutic Uses. International Journal of Scientific Research and Innovative Technology. 5(1):161-172.
- Taupin, P. 2010. Transplantation of Cord Blood Stem Cells for Treating Hematologic Diseases and Strategies to Improve Engraftment. Vol. 7(6):703-715.
- Roura, S., Pujal, J., Gálvez-Montón, C. et al. The Role and Potential of Umbilical Cord Blood in An Era of New Therapies: A Review. Stem Cell Research & Therapy. Vol.6:123.
- Hassan, G., Kasem, I., Soukkarieh, C., and Aljamali, M. 2017. A Simple Method to Isolate and Expand Human Umbilical Cord Derived Mesenchymal Stem Cells: Using Explant Method and Umbilical Cord Blood Serum. International Journal of Stem Cells. Vol. 10(2):184–192.
- Liau, L. L., Ruszymah, B. H. I., Ng, M. H., & Law, J. X. 2019. Characteristics and clinical applications of Wharton’s jelly-derived mesenchymal stromal cells. Current Research in Translational Medicine Volume 68, Issue 1, January 2020, Pages 5-16.