Stem cell untuk autisme menjadi salah satu harapan besar bagi para penderita ASD. Autism Spectrum Disorders (ASD) atau autisme adalah kondisi kelainan perkembangan sel saraf (sel neuron) yang terlihat pada awal masa anak-anak dan ditandai dengan adanya kesulitan berkomunikasi verbal dan nonverbal, pengulangan tingkah laku, dan ketertarikan dangkal dan obsesif pada suatu hal. Gangguan autisme secara pasti pada anak dapat dideteksi saat anak berusia 18 sampai 36 bulan. Namun, gejala autisme sudah dapat terlihat sejak anak berumur 8 sampai 12 bulan. Anak mengalami gangguan autis biasanya akan kesulitan berkomunikasi dengan orang lain [1].
Prevalensi penderita autis di dunia terus meningkat. Data dari World Health Organization/ WHO tahun 2018 menyatakan bahwa diperkirakan 1:160 anak di dunia mengalami autisme. Bahkan, di Amerika, berdasarkan laporan dari Center for Disease Control (2016), sekitar 1:54 anak didiagnosis dengan gangguan autisme. Pada tahun 2024, Wakil Menteri Kesehatan RI, dr Dante Saksono Harbuwono, memperkirakan anak dengan penderita autisme di Indonesia mencapai 2,4 juta dari 4,5 juta kelahiran anak per tahun. Hal ini berarti 1 di antara 100 anak mengidap autism spectrum disorder (ASD).
Patofisiologi atau penyebab autisme sangat kompleks dan dapat disebabkan oleh berbagai faktor, seperti faktor genetik, disregulasi sitem imun, dan neuroinflamasi. Faktor genetik umumnya dipengaruhi oleh mutasi gen akibat pengaruh lingkungan seperti polusi udara, merkuri, dan zat logam lain penyebab mutasi [2]. Oleh karena itu, selama masa kehamilan, ibu hamil harus memperhatikan dan memilah asupan nutrisi untuk bayinya. Misalnya, dalam mengkonsumsi ikan laut, harus diperhatikan juga sumbernya, karena tak jarang ikan laut yang dikonsumsi terkadang mengandung merkuri atau logam berbahaya lainnya. Anak dengan gangguan autisme juga teridentifikasi memiliki kandungan logam darah yang tinggi dibandingkan anak normal [3].
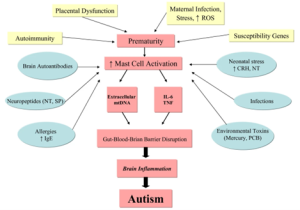
Selain faktor genetik, autisme juga dapat disebabkan karena neuroinflamasi pada otak. Neuroinflamasi dapat terjadi ketika bayi masih di dalam kandungan. Penyebab utama neuroinflamasi pada janin yaitu adanya pengaktifan sel mast. Sel mast yang aktif akan mengeluarkan mediator inflamasi seperti sitokin yang akan berinteraksi dengan sel mikroglia [4]. Mikroglia merupakan bentuk respon fisiologi yang bisa melawan benda asing yang masuk ke otak dan tindakan over reaction dari mikroglia akan berujung pada gangguan neurodegeneratif seperti autis [5]. Tingginya zat sitokin seperti TNF-α dan IL-6 di otak dapat menyebabkan neuroinflamasi. Nuroinflamasi yang kronis menjadi salah satu penyebab terjadinya gangguan autisme [6]. Selain itu, pengeluaran mediator (IL-6 dan TNF-α) dari sel mast akan mengganggu kerja Blood Brain Barrier (BBB) yang menjaga homeostasis sistem saraf pusat dan pada konsentrasi tinggi akan mengurangi jumlah kelenjar, dendrit, dan kualitas serta aktivitas neuron hingga menyebabkan brain inflammation yang memicu gangguan autis [7]. Bayi yang lahir prematur juga lebih beresiko memiliki gangguan autis. Hal ini dikarenakan bayi prematur akan sensitif terhadap berbagai faktor lingkungan dan stress yang menjadi salah satu penyebab aktifnya sel mast [6].
Pengobatan dan terapi bagi penderita autisme sudah banyak dilakukan, tetapi karena gangguan Autisme ini bersifat kronik, maka tentu perlu tenaga dan biaya yang besar dalam pengobatannya. Baru-baru ini, pengobatan dan terapi stem cell untuk penderita autisme mulai dilirik sebagai salah satu alternatif yang menjanjikan. Sel punca mesenkimal (MSC) memiliki kemampuan regeneratif dan dapat membantu neurogenesis di otak yang lambat dan terbatas pada penderita autisme. Sel punca mesenkimal (MSC) juga memiliki kemampuan angiogenesis serta dapat mensintesis dan melepaskan sitokin antiinflamasi yang dapat memulihkan plastisitas dari sel saraf. Setelah transplantasi, MSC akan bermigrasi ke lokasi atau bagian tubuh yang cedera. Dalam beberapa kasus, MSC juga memiliki mekanisme parakrin dan merespons lingkungan lokal dengan mensekresikan beberapa faktor terlarut untuk perbaikan jaringan [8,9,10].
Pada pasien autisme, juga ditemukan adanya disregulasi sistem imun dan perubahan respon imun bawaan. Anak yang menderita autisme biasanya mengalami perubahan imunitas yang diperantarai oleh sel T dan sel B, juga ketidakseimbangan berbagai jenis sel T seperti CD3+, CD4+, CD8+, dan sel NK [11]. Oleh karenanya, efek regulasi yang dihasilkan oleh MSC dapat memulihkan keseimbangan imun yang tidak bisa diperoleh dengan terapi obat atau intervensi farmasi. MSC dapat menghambat proliferasi sel T dan sel NK, serta penekanan produksi imunoglobulin, dan pematangan sel dendritik (DC) sehingga terapi MSC dapat memberikan efek teraupetik yang unik untuk penderita autisme [12]. Selain itu, MSC mampu menghambat produksi sitokin pro-inflamasi limfosit T. Terapi MSC pada penderita autisme, umumnya menargetkan jaringan saraf. Setelah masuk ke jaringan saraf, MSC dapat mensintesis dan melepaskan berbagai molekul bioaktif seperti sitokin anti-inflamasi, ligan Flt-3, faktor perangsang koloni makrofag, dan faktor sel induk yang pada dapat memulihkan jaringan saraf yang cedera. Aktivitas parakrin MSC yang kuat ini tampaknya menjadi mekanisme yang paling menonjol terkait manfaat fungsional yang diperoleh dari transplantasi MSC[13].
Kemampuan regeneratif MSC juga telah diuji dalam penelitian dasar dengan model hewan, uji praklinik dan klinik, dan banyak yang telah menunjukkan prospek dan janji terapeutik yang hebat. Sel punca mesenkimal dari tali pusat (UC-MSCs) merupakan sumber sel punca yang menjanjikan dibandingkan dengan sumber sel punca lain seperti MSC dari sumsum tulang belakang (BM-MSCs), yang umumnya selnya diperoleh dengan cara invasif. Selain itu, dibandingkan dengan MSC lain yang digunakan dalam penelitian klinis, sel punca UC-MSC memiliki sejumlah keunggulan. Sel punca mesenkimal dari tali pusat (UC-MSCs) berasal dari sumber allogenik dan mudah didapatkan, tidak menimbulkan masalah etis, mudah juga untuk dikembangbiakkan, serta mudah untuk disimpan dan memenuhi standar penelitian klinis dengan baik [14].
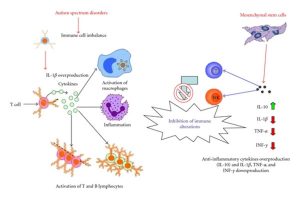
Penelitian dari Zhang et al., (2013), telah memeriksa keamanan dan kemanjuran pengobatan transplantasi sel punca mesenkimal dari tali pusat manusia pada 37 anak dengan gangguan autisme. Penelitian tersebut bertujuan untuk memeriksa keamanan dan kemanjuran pengobatan transplantasi sel mononuklear darah tali pusat manusia (CBMNCs) dan/atau sel punca mesenkimal yang berasal dari tali pusat manusia (UCMSCs). Rute administrasi atau pemberian sel punca dilakukan secara intratekal dan intravena. Menurut penulis, terapi sel punca yang dilakukan terbukti aman, tanpa efek samping langsung atau jangka panjang, serta tidak ada reaksi imunologi, alergi, atau kejadian serius lainnya. Transplantasi sel juga menunjukkan kemanjuran dan perbaikan seperti peningkatan respons visual, intelektual dan emosional, adaptasi terhadap perubahan, kontrol rasa takut atau gugup, dan peningkatan komunikasi non-verbal, sebagaimana yang diukur dengan Childhood Autism Rating Scale. Penelitian tersebut juga menunjukkan perbaikan pada parameter yang dievaluasi dengan Aberrant Behavior Checklist seperti kelesuan/penarikan diri sosial, hiperaktif, perilaku stereotip, dan ucapan yang tidak pantas [15]. Studi klinis juga pernah dilakukan oleh Dawson et al. (2017), Carpenter et al. (2019), dan Sun et al. (2020), dimana terapi stem cell yang terbukti aman serta tidak menimbulkan efek samping yang serius.[16, 17,18]
Kurangnya psikofarmasi yang aman dan efektif serta terapi medis definitif lainnya, bersama dengan pemahaman terbatas tentang patofisiologi, telah menciptakan urgensi untuk mengidentifikasi terapi baru dan lebih efektif. UC-MSCs tampaknya juga menawarkan potensi yang lebih baik dalam pengobatan neurodegeneratif untuk gangguan kompleks seperti autisme daripada pengobatan farmasi yang ada [19]. Hasil dari berbagai studi klinis yang telah dilakukan menunjukkan bahwa sel punca memberikan efek yang sangat baik dan menjanjikan sebagai terapi autisme. Namun demikian, penelitian dan uji klinis yang lebih besar juga tetap diperlukan untuk menjamin keandalannya.
Referensi:
[2] Wijngaarden E, V., Davidson PW, Smith TH, Evans K, Yost K, Love T, Thurston SW, Watson GE, Zareba G, Burns CM, Shamlaye CF, Myers GJ. 2013. Autism Spectrum Disorder Phenotypes and Prenatal Exposure to Methylmercury. Epidemiology, 24(5): 651-659.
[3] Picciotto, H., Green PG, Delwiche L, Hansen R, Walker C, Pessah IN. 2010. Blood Mercury Concentrations in Charge Study Children with and without Autism. Environ Health Perspect, 118(1): 161-166.
[4] Anderson A.A., Ushakov D.S., Ferenczi M.A., Mori R., Martin P., & Saffell J.L. 2008. Morphoregulation by Acetylcholinesterase in Fibroblasts and Astrocytes. J Cell Physiol, 215(1):82–100.
[5] Wang, Q. M., Luo, A. Z., & Kong, X. 2014. Neuroinflamation and Autism. N A J Med Sci, 7(3):118-122.
[6] Angelidou, A., Asadi, S., Alysandratos, K. D., Karagkouni, A., Stella K., & Theoharides, T. C. 2012. Perinatal Stress, Brain Inflammation and Risk of Autism Review and Proposal. BMC Pediatrics, 12:89.
[7] Gilmore, J.H., Fredrik, J. L., Vadlamudi S, Lauder, J.M. 2004. Prenatal Infection and Risk for Schizophrenia: IL-1beta, IL-6, and TNFalpha Inhibit Cortical Neuron Dendrite Development. Neuropsychopharmacology, 29:1221–1229.
[8] Siniscalco D, Sapone A, Cirillo A, Giordano C, Maione S, Antonucci N. Autism spectrum disorders: is mesenchymal stem cell personalized therapy the future? J Biomed Biotechnol. 2012;2012:480289.
[9] Siniscalco D, Bradstreet JJ, Sych N, Antonucci N. Perspectives on the Use of Stem Cells for Autism Treatment. Stem Cells Int. 2013;2013:262438.
[10] Sohni A, Verfaillie CM. Mesenchymal Stem Cells Migration Homing and Tracking. Stem Cells Int. 2013;2013:130763.
[11] Hoogduijn MJ, Popp F, Verbeek R, Masoodi M, Nicolaou A, Baan C, Dahlke MH. The immunomodulatory properties of mesenchymal stem cells and their use for immunotherapy. Int Immunopharmacol. 2010; 10:1496-1500.
[12] Meirelles Lda S, Fontes AM, Covas DT, Caplan AI. Mechanisms involved in the therapeutic properties of mesenchymal stem cells. Cytokine Growth Factor Rev. 2009;20:419-427.
[13] El-Ansary A, Al-Ayadhi L. Neuroinflammation in autism spectrum disorders. J Neuroinflammation. 2012;9:265.
[14] Siniscalco D, Bradstreet JJ, Sych N, Antonucci N. Mesenchymal stem cells in treating autism: Novel insights. World J Stem Cells 2014; 6(2): 173-178.
[15] Zhang Y, Liu M, Qiuwaxi JN, Ashwood P, Cho SC, Huan Y, Ge RC, Chen XW, Wang ZJ. Transplantation of human cord blood mononuclear cells and umbilical cord-derived mesenchymal stem cells in autism. J Transl Med. 2013;11:196.
[16] Carpenter, K. L. H., Major, S., Tallman, C., Chen, L. W., Franz, L., Sun, J., et al. (2019). White Matter Tract Changes Associated with Clinical Improvement in an Open-Label Trial Assessing Autologous Umbilical Cord Blood for Treatment of Young Children with Autism. Stem Cells Transl. Med. 8, 138–147. doi:10.1002/sctm.18-0251
[17] Dawson, G., Sun, J. M., Davlantis, K. S., Murias, M., Franz, L., Troy, J., et al. (2017). Autologous Cord Blood Infusions Are Safe and Feasible in Young Children with Autism Spectrum Disorder: Results of a Single-Center Phase I Open-Label Trial. Stem Cells Transl. Med. 6, 1332–1339. doi:10.1002/sctm.16-0474
[18] Sun, J. M., Dawson, G., Franz, L., Howard, J., McLaughlin, C., Kistler, B., et al. (2020). Infusion of Human Umbilical Cord Tissue Mesenchymal Stromal Cells in Children with Autism Spectrum Disorder. Stem Cells Transl. Med. 9, 1137–1146. doi:10.1002/sctm.19-0434.
[19] Ghosh A, Michalon A, Lindemann L, Fontoura P, Santarelli L. Drug discovery for autism spectrum disorder: challenges and opportunities. Nat Rev Drug Discov. 2013;12:777-790.